Przełomowe technologie zmieniają sposób, w jaki prowadzone są badania nad nowymi lekami. Dr inż. Roman Szafran i jego zespół stworzyli urządzenie mikrofluidalne, które pozwala na szybsze i bardziej precyzyjne testy przesiewowe. Co więcej, dzięki temu wynalazkowi możliwe jest ograniczenie badań na zwierzętach, otwierając nowe perspektywy dla medycyny spersonalizowanej.

W cyklu wywiadów Centrum Innowacji i Biznesu przedstawiamy rozmowę z dr inż. Romanem Szafranem z Wydziału Chemicznego Politechniki Wrocławskiej.
dr inż. Roman Szafran jest adiunktem w Katedra Biochemii, Biologii Molekularnej i Biotechnologii na Wydziale Chemicznym Politechniki Wrocławskiej. Jest specjalistą z zakresu inżynierii chemicznej, projektowania i wytwarzania urządzeń mikrofluidalnych, mikroreaktorów, biochipów oraz systemów magazynowania energii.
Rozwija autorskie oprogramowanie open source Microflow3D (www.microflow.pwr.edu.pl) do symulacji zjawisk w mikroskali.
Królik doświadczalny czy szczur laboratoryjny? Wywiad z dr inż. Romanem Szafranem, Liderem projektu „Mikrosystem do szybkich testów przesiewowych substancji leczniczych”.

dr inż. Roman Szafran
Katedra Biochemii, Biologii Molekularnej i Biotechnologii
Dzień dobry. Dziękujemy za możliwość rozmowy.
W połowie bieżącego roku uzyskaliście patent na „Magnetyczne urządzenie mikrofluidalne do szybkich badań przesiewowych” – proszę nam opowiedzieć, na czym polega Państwa wynalazek?
Dzień dobry. Jest to mikrosystem gradientowy, inaczej urządzenie mikrofluidalne lub też układ „lab-on-a-chip” przeznaczony do prowadzenia badań w fazie przedklinicznej nowych substancji leczniczych oraz doboru metod leczenia i dawkowania leków w medycynie spersonalizowanej.
Brzmi to skomplikowanie
Nie, to konstrukcyjnie bardzo proste urządzenie w formie plastikowej płytki, wyposażone w szereg studzienek i mikrokanałów, trochę podobne do płytki wielodołkowej i w założeniu o podobnych zastosowaniach, ale dużo większej funkcjonalności.
Płytki wielodołkowej?
Tak, płytki wielodołkowe są standardowym narzędziem w badaniach analitycznych i klinicznych w laboratoriach diagnostycznych wykorzystywanymi w biologii molekularnej i komórkowej, testach immunoenzymatycznych (ELISA), w farmakologii, biochemii, badaniach nad szczepionkami i wielu innych dziedzinach – to po prostu podstawowe narzędzie laboratoryjne.
Zatem w czym mikrosystem gradientowy jest lepszy od płytki wielodołkowej?
Zanim odpowiem na to pytanie, muszę Państwu przybliżyć pokrótce samą procedurę badawczą, bo sam mikrosystem to jeszcze nie wszystko. Istotą testów komórkowych np. cytoaktywności czy cytotoksyczności substancji np. cytostatyków, czyli leków stosowanych w chemioterapii, jest wykonywanie badań na żywych komórkach prawidłowych i nowotworowych w szerokim zakresie stężeń. Podobnie jest w przypadku medycyny spersonalizowanej, w leczeniu pacjentów onkologicznych, z tym że wówczas testy wykonuje się na liniach komórkowych wyprowadzonych z komórek pobranych wprost ze zmiany nowotworowej np. podczas biopsji. W teorii, procedura polega na doborze stężeń terapeutyków, zwykle mieszaniny cytostatyków, dla konkretnej zamiany nowotworowej i konkretnego pacjenta. Problem w tym, że ilość komórek dostępnych z biopsji jest niezwykle mała, a standardowa procedura wymaga przeprowadzenia testów dla szerokiego zakresu stężeń.
I teraz mogę wrócić do Pani pytania „w czym mikrosystem gradientowy jest lepszy od płytki wielodołkowej” – mikrosystem umożliwia prowadzenie badań na mikrohodowli komórkowej w stałym lub zmiennym w czasie gradiencie jednej lub dwóch substancji bioaktywnych oraz w mikroobjętościch i w kontrolowanych warunkach natlenienia.
Co to w praktyce oznacza?
Dalece bardziej złożony model „in vitro” np. zmiany nowotworowej, niemożliwy do uzyskania klasycznymi metodami. W badaniach i rozwoju produktów leczniczych w fazie odkrycia (ang. discovery) oraz w fazie badań przedklinicznych przekłada się to znaczne obniżenie kosztów i przyspieszenie prac. A wszystko to z wykorzystaniem wprost komórek człowieka, bez potrzeby prowadzenia badań na zwierzętach na wczesnych etapach badań przedklinicznych. W medycynie spersonalizowanej – dzięki możliwości wyprowadzenia modelu z niewielkiej liczby komórek w krótkim czasie – nie generuje opóźnień w diagnostyce i leczeniu pacjenta. To również możliwość określenia efektów krzyżowych dwóch substancji oraz określenia wpływu zmian stężeń substancji aktywnej (badania farmakokinetyczne) na wytworzenie np. lekooporności.
Czy to oznacza, że już wkrótce nie będziemy musieli wykorzystywać zwierząt w badania nowych leków?
Na pewno możemy ograniczyć ich udział do absolutnego minimum. Pamiętajmy, że im bardziej złożony model komórkowy, tym lepsze przełożenie wyników badań „in vitro” na wyniki rzeczywiste – to również większe bezpieczeństwo ludzi w badaniach klinicznych. Ale to również możliwość prowadzenia testów w immunoterapii onkologicznej, przed podaniem leku pacjentowi. To zupełnie nowe możliwości. Jest szansa, że przysłowiowego królika, czy szczura, wkrótce zastąpi biochip.
Otrzymany patent potwierdza oryginalność pomysłu, ale czy nie ma konkurencyjnych rozwiązań na świecie? – wszakże układy mikrofluidalne obecnie wchodzą przebojem do diagnostyki medycznej.
To prawda, od czasów pandemii obserwujemy dynamiczny rozwój immunologicznych testów antygenowych, dostępnych obecnie w każdej aptece w formie tzw. testów kasetkowych – to również są urządzenia mikrofluidalne, jednak o zupełnie innym zastosowaniu. Naszą konkurencją są złożone mikrofluidalne modele komórkowe 3D, jednak mają one podstawową wadę – są bardzo pracochłonne w przygotowaniu oraz trudne w analizie wyników – wymagają wyspecjalizowanych narzędzi analitycznych (mikroskopia konfokalna) lub obróbki materiału w formie bloczków parafinowych. To z kolei wiąże się z małą przepustowością procedury i dużymi kosztami wdrożenia. Nasze rozwiązanie przystosowane zostało do standardowych narzędzi dostępnych w laboratoriach – czytników płytek wielodołowych i analizy wyników pod mikroskopem optycznym. Dzięki temu znajduje on zastosowane w rutynowych badaniach przesiewowych substancji leczniczych i nie wymaga dodatkowych inwestycji w kosztowny sprzęt.
To bardzo specjalistyczne narzędzie, jaki jest więc krąg potencjalnych odbiorców, bo zapewne nie jest to produkt dla Kowalskiego?
I tak i nie. Ponieważ na co dzień testujemy i wykorzystujemy mikrosystem w badaniach laboratoryjnych – jest to domyślny obszar zastosowania i związany z nim krąg odbiorców – laboratoria naukowe i centra badawcze firm farmaceutycznych. Jednak kolejny etap rozwoju technologii przewiduje wdrożenie rozwiązania w terapii spersonalizowanej i medycynie precyzyjnej, a to już Kowalskiego może dotyczyć.
Zatem jakie przewidujecie dalsze kroki w rozwoju technologii? Co już udało się osiągnąć, a co jeszcze przed wami?
Otrzymaliśmy już w sumie trzy patenty krajowe na nasze rozwiązanie, mamy dodatkowo trzy krajowe zgłoszenia patentowe i jedno miedzynarodowe PCT, jednak ciągle poszukujemy inwestora strategicznego. Wspólnie z Uniwersytetem Medycznym we Wrocławiu oraz w Łodzi, Politechnika Wrocławska zawiązała konsorcjum, którego celem jest komercjalizacja rozwiązania w ramach grantu naukowo-badawczego TEAM NET FENG. Pierwszym rezultatem połączonych wysiłków trzech uczelni jest znalezienie czterech podmiotów gospodarczych zainteresowanych czynnym udziałem w rozwoju produktu. Projekt zakłada szeroką walidację urządzenia w warunkach pracy w laboratorium na sześciu liniach komórkowych — prawidłowych i nowotworowych, wykorzystywanych w badaniach nad nowotworami jelita grubego oraz mózgu. Ponadto, badania walidacyjne obejmują osiem substancji bioaktywnych, w tym cytostatyki, substancje przeciwzapalne i antybiotyki powszechnie używane w medycynie oraz nowo syntetyzowane substancje o potencjalnym działaniu terapeutycznym. Jeśli projekt uzyska dofinansowanie, na jego zakończenie, będziemy dysponować zoptymalizowanym urządzeniem, zwalidowanymi procedurami analitycznymi o potwierdzonej dokładności oraz technologią produkcji do 1000 szt./miesiąc. Będzie to doskonały punkt wyjścia dla wdrożenia urządzenia do produkcji wielkoseryjnej.
Kto będzie pracował nad projektem?
Liderem niewielkiego zespołu badawczego na Politechnice Wrocławskiej jestem ja. Wspólnie z dr inż. Agnieszką Pawłowską oraz studentami i doktorantem będziemy rozwijać technologię fabrykacji urządzenia oraz implementować nowe procedury analityczne. Na Uniwersytecie Medycznym im. Piastów Śląskich we Wrocławiu liderować zespołowi badawczemu będzie Pani dr hab. inż. Benita Wiatrak, a na Uniwersytecie Medycznym w Łodzi badania będą prowadzone pod kierunkiem Pani prof. dr hab. Urszuli Lewandowskiej. Dzięki udziałowi dwóch uczelni medycznych możliwa będzie niezależna walidacja urządzenia.
Dziękujemy za rozmowę. Czy jest coś, co chciałby Pan jeszcze dodać?
Chciałbym zachęcić wszystkie osoby zainteresowane tematem do współpracy. Tworzymy zgrany zespół, w którym jest miejsce dla każdego, od studenta, przez doktoranta, po pracowników naukowych z doświadczeniem. Zapraszamy również potencjalnych inwestorów do kontaktu.
Dziękujemy za poświęcony czas i życzymy powodzenia w dalszych badaniach.
Dziękuję bardzo.

Pięciokanałowy mikrosystem gradientowy z rozwiniętym gradientem stężenia dwóch substancji barwnych

Trójkanałowy mikrosystem gradientowy z rozwiniętym gradientem stężenia dwóch substancji barwnych umieszczony na programatorze magnetycznym

Rozkład struktur 3D w mikrokanale, utworzonych z ferromagnetycznych mikrokapsułek modyfikowanych owierzchniowo przeciwciałami monoklonalnymi, stanowiących nośnik komórek

Mikrostruktury 3D
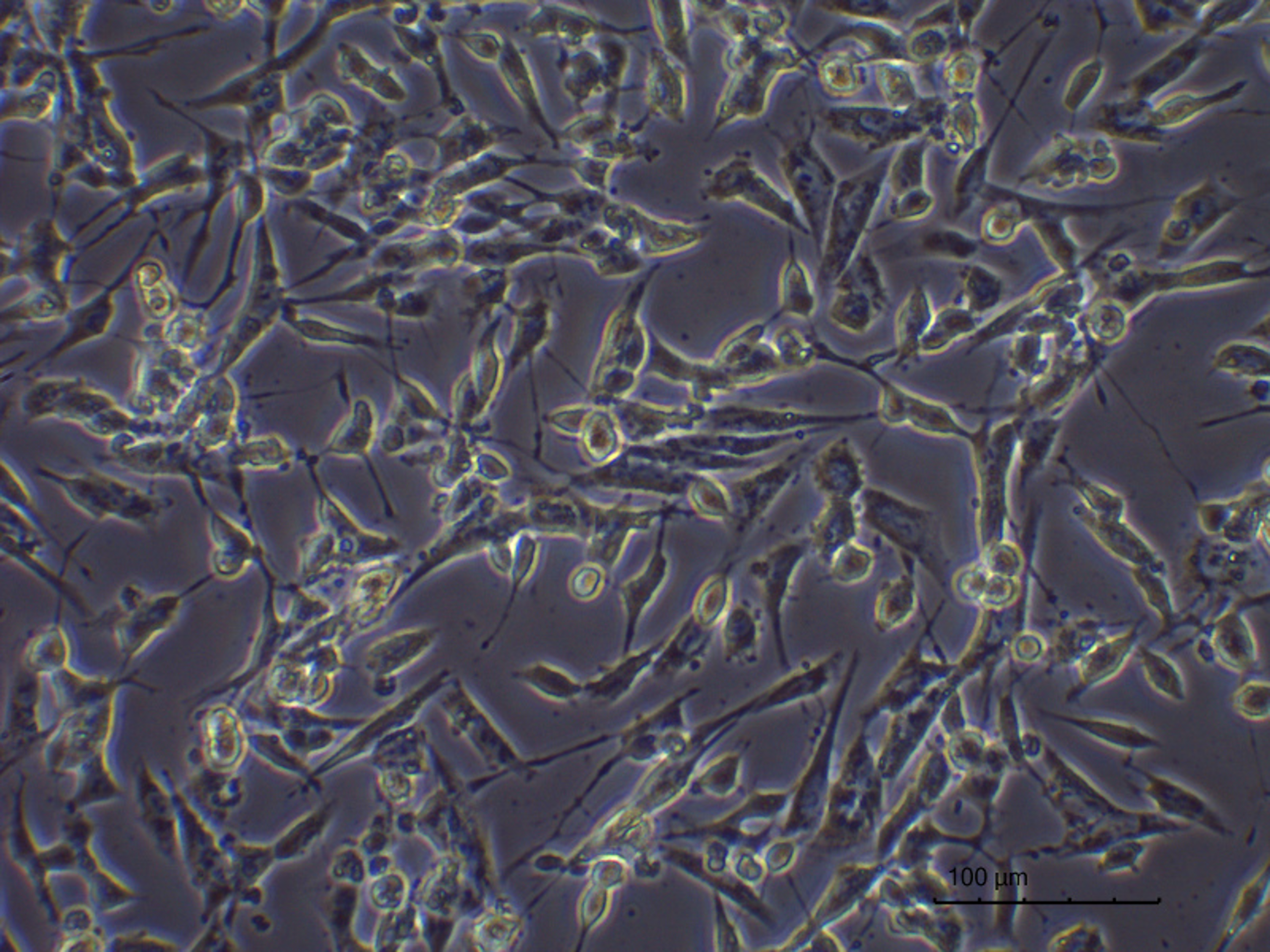
Hodowla komórkowa w mikrokanale, linia nowotworowa komórek człowieka (neuroblastoma) SH-SY5Y





